гематологическая токсичность при химиотерапии что это такое
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
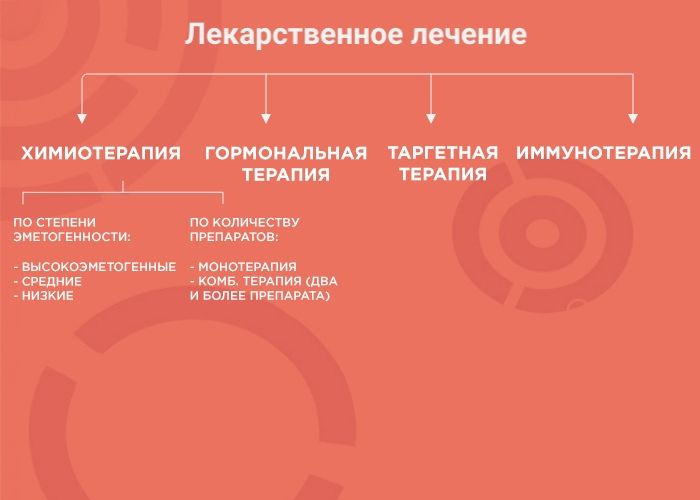
Что такое лекарственное лечение
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
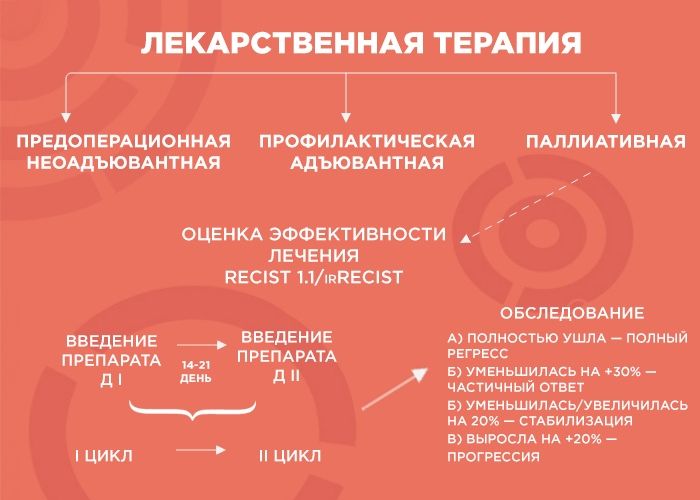
Цели и оценка эффективности лекарственного лечения
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.
Гематологическая токсичность при химиотерапии что это такое
Основной задачей лекарственных средств, используемых в химиотерапии, является уничтожение раковых клеток при нанесении минимального урона здоровым элементам человеческого тела. Для достижения данной цели ученые стараются определить уникальные характеристики, свойственные злокачественным клеткам опухолей, отличающие данные элементы от здоровых тканей. Отдельные свойства раковых клеток могут служить целью для химиотерапевтических препаратов и отличать данные элементы от здоровых тканей. Одной из основных отличительных черт опухолей является быстрый рост и неконтролируемое размножение клеток [1, 2, 3, 4]. Вот почему резонно много внимания уделяется циклу размножения клетки и воздействию на отдельные стадии данного процесса. При химиотерапии больше всего страдают элементы, которые характеризируются быстрым ростом и размножением. Вышеупомянутая особенность становится очевидной при рассмотрении основных побочных эффектов данного метода лечения.
Цель исследования – провести анализ основных гематологических осложнений при применении различных методов полихимиотерапии.
Задача исследования: изучить частоту встречаемости отдельных гематологических симптомов при различных вариантах полихимиотерапии, а также эффективность лечения в возрастном и клиническом аспектах.
Материалы и методы исследования
В исследование было включено 122 больных с раком легкого. Возраст пациентов составил от 40 до 59 лет (средний возраст 47,2 ± 4,3 года), мужчин – 88 чел., женщин – 34 чел. Все пациенты были отнесены к трем группам.
Были выделены следующие подгруппы:
– получающие «традиционную» (этапную) химиотерапию (n = 50): возраст пациентов составил от 40 до 59 лет (средний возраст 45,3 ± 3,3 года), мужчин – 41 чел., женщин – 9 чел.;
– получающие таргетную терапию (n = 31): возраст пациентов составил от 40 до 59 лет (средний возраст 48,4 ± 4,4 года), мужчин – 25 чел., женщин – 6 чел.;
– получающие симптоматическое лечение (n = 41): возраст пациентов составил от 40 до 59 лет (средний возраст 50,1 ± 3,1 года), мужчин – 22 чел., женщин – 21 чел.
Результаты исследования и их обсуждение
Эффективность лечения у пациентов разных возрастных групп, получающих стандартную полихимиотерапию и таргетную терапию, представлена в табл. 1.
Как видно из табл. 1, у всех больных, получающих и стандартную полихимиотерапию, и таргетную терапию, полной регрессии заболевания не наблюдалось. Эффект проявлялся в виде частичной регрессии опухоли и/или метастазов, который и равнялся общей эффективности. Общий эффект у больных, получающих стандартную полихимиотерапию, составил 8,0 %. Среди больных, получающих таргетную терапию, общий эффект составил 16,1 %. Стабилизация опухолевого процесса в группе пациентов, получающих стандартную терапию, зафиксирована у 23 (46,0 %); в группе пациентов, получающих таргетную терапию, – у 13 (41,9 %).
Материалы конгрессов и конференций
VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ С ТРАНСПЛАНТАЦИЕЙ АУТОЛОГИЧНЫХ КЛЕТОК ПРЕДШЕСТВЕННИКОВ ГЕМОПОЭЗА ПРИ ЛЕЧЕНИИ ПАЦИЕНТОВ С СОЛИДНЫМИ ОПУХОЛЯМИ: СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ
Ф. Гутиеррес Дельгадо
Химиотерапия, применяемая в настоящее время, позволила улучшить прогноз пациентов со злокачественными новообразованиями, однако доля опухолей, которые могут быть излечены с помощью стандартных доз цитостатиков, не велика. В качестве лечения, потенциально способного увеличить количество «излечиваемых» опухолей, была предложена высокодозная химиотерапия с трансплантацией аутологичных клеток предшественников гемопоэза (ВХТ/ТКПГ). Эффективность ВХТ/ТКПГ была оценена при лечении пациентов с рядом солидных новообразований (рак молочной железы, яичников, яичек, рак легкого). В настоящий момент для проведения высокодозной химиотерапии в основном применяют препараты с дозолимитирующей гематологической токсичностью, обладающие активностью при лечении данных новообразований. В связи с более быстрым восстановлением гемопоэза при использовании клеток предшественников гемопоэза из периферической крови (КПГ ПК) этот вид гемопоэтического материала практически заменил ранее использовавшийся костный мозг. Улучшение поддерживающего лечения значительно уменьшило токсическую смертность после высокодозной химиотерапии. Несмотря на это, результаты большинства исследований, посвященных использованию высокодозной химиотерапии при солидных опухолях, разочаровывающие. При лечении больных с местно-распространенным и метастатическим раком молочной железы рандомизированные исследования не показали преимуществ высокодозной химиотерапии по сравнению со стандартной. По данным исследований II фазы высокодозная терапия показала свою эффективность при лечении больных с первым рецидивом рака яичка, чувствительным к препаратам платины, рецидивом рака яичников и у молодых больных с ограниченной стадией мелкоклеточного рака легкого. Однако эти данные нуждаются в подтверждении результатами исследований III фазы. Несмотря на то, что рандомизированные исследования поставили под сомнение возможность излечить больных раком молочной железы с помощью ВХТ/ТКПГ, некоторые подгруппы пациентов с солидными опухолями все же выигрывают от проведения этого экспериментального вида лечения. В связи с этим с целью улучшения результатов высокодозной химиотерапии критическому пересмотру должны быть подвергнуты взгляды на дизайн исследований, в том числе время проведения высокодозного лечения, а также режимы кондиционирования и посттрансплантационной поддержки.
Современная стандартная химиотерапия имеет весьма скромное влияние на отдаленные результаты лечения больных с солидными опухолями. ВХТ/ТКПГ была предложена и в дальнейшем изучалась как подход, потенциально способный излечить большее количество больных со злокачественными новообразованиями. Обоснованием этого явились многочисленные клинические и экспериментальные работы, показавшие наличие прямой зависимости между дозой цитостатиков и противоопухолевым эффектом (1). Основной задачей режима кондиционирования является уничтожение опухолевых клеток. Стволовые клетки предшественники гемопоэза, получаемые из костного мозга и/или периферической крови, при аутологичной трансплантации используются лишь для восстановления кроветворной функции, поврежденной высокими дозами цитостатиков. Роль высокодозной химиотерапии с трансплантацией аутологичных клеток предшественников гемопоэза хорошо оценена в педиатрической практике (нейробластома и ряд других опухолей детского возраста), у взрослых пациентов с гематологическими (острый лимфобластный и миелобластный лейкозы, хронический лимфолейкоз и миеломная болезнь) и солидными (рак молочной железы, яичников, яичек, мелкоклеточный рак легкого) злокачественными новообразованиями. К сожалению, рецидив основного заболевания остается основной причиной неудач высокодозного лечения. (2). Данный обзор посвящен методике проведения ВХТ/ТКПГ, клиническим исследованиям в этой области, а также перспективам данного вида лечения.
I. МЕТОДИКА ПРОВЕДЕНИЯ ВЫСОКОДОЗНОЙ ХИМИОТЕРАПИИ С ТРАНСПЛАНТАЦИЕЙ АУТОЛОГИЧНЫХ КЛЕТОК ПРЕДШЕСТВЕННИКОВ ГЕМОПОЭЗА
Клетки предшественники гемопоэза: источники, методика получения, хранения и реинфузии
В последнее десятилетие клетки предшественники гемопоэза из периферической крови практически полностью заместили ранее использовавшийся для трансплантации костный мозг. В норме периферическая кровь содержит небольшое количество клеток предшественников гемопоэза (что может быть определено с помощью подсчета CD34+ клеток или колониеобразующих единиц), однако этого количества недостаточно для успешного восстановления гемопоэза после высокодозной химиотерапии. Введение гранулоцитарного или гранулоцитарно-макрофагального колониестимулирующих факторов (Г-КСФ и ГМ-КСФ соответственно) в монотерапии или после цитостатической миелосупрессивной терапии увеличивает содержание CD34 позитивных клеток в периферической крови. (3). Побочные эффекты назначения ростовых факторов мало выражены и легко купируются (4). Среди цитостатических алкилирующих агентов наибольшим мобилизующим эффектом обладает циклофосфамид. (2).
Точная доза CD34+ клеток, необходимых для успешного восстановления гемопоэза, не известна, но обычно считается достаточным получение от 4 до 6 х 106 CD34+ клеток на килограмм массы больного. Стволовые клетки, мобилизованные из костного мозга в периферическую кровь, легко собираются при помощи сепараторов клеток крови. Двух процедур афереза обычно оказывается достаточным для получения адекватного количества CD34+ клеток (3).
Аутологичный трансплантат может содержать опухолевые клетки, потенциально отвечающие за рецидив после трансплантации. Для удаления злокачественных клеток из трансплантата используются различные методики негативной селекции. Негативная селекция может быть осуществлена при помощи обработки in vitro костного мозга или клеток предшественников гемопоэза из периферической крови цитостатиками (мафосфамид, 4-гидропероксициклофосфамид), а также физическим удалением злокачественных клеток.
Позитивная селекция представляет собой выделение стволовых клеток на специальных колонках, одержащих антитела к CD34 антигену, или на магнитных сортерах. Трансплантат, подвергшийся позитивной или негативной селекции, способен надежно восстанавливать гемопоэз, однако преимущества проведения очистки не были показаны в рандомизированных исследованиях (5).
До момента проведения трансплантации стволовые клетки должны храниться в специальных условиях. Хранение при комнатной температуре или в обычном холодильнике (+4°C) возможно лишь на протяжении нескольких часов или дней; для более длительного хранения необходима криоконсервация трансплантата. (6). Современные методики криоконсервации предусматривают использование в качестве консерванта диметилсульфоксида (ДМСО) или его комбинации с гидроксикрахмалом.
Реинфузия стволовых клеток производится внутривенно в течение нескольких минут после разморозки без проведения дополнительных манипуляция (за исключением фильтрации). Большинство пациентов переносят реинфузию без побочных эффектов, однако у небольшой доли больных может наблюдаться лихорадка, кашель или умеренно выраженная одышка. Данные побочные явления купируются проведением симптоматической терапии. Небольшие объемы концентрированных CD34+ клеток обычно переносятся легче, чем большее количество гемопоэтического материала, не подвергшегося селекции (6).
Режимы, используемые для высокодозного лечения больных с солидными опухолями, включают цитостатики, имеющие гематологическую дозолимитирующую токсичность и активные в отношении данного заболевания. Выбор режима обычно также зависит от возраста и общего состояния больного, вида трансплантата. Наиболее часто используются алкилирующие агенты, антиметаболиты и этопозид (2). Карбоплатин также является важным компонентом высокодозных режимов. Высокие дозы карбоплатина, тиофосфамида и циклофосфамида используются в одном из наиболее популярных режимов для лечения больных раком молочной железы STAMP-V. Другие высокодозные режимы включают циклофосфамид, этопозид, цисплатин + адриамицин (CEP) или бусульфан, мелфалан и тиофосфамид (Bu/Mel/T) (7). Карбоплатин и этопозид в сочетании или без циклофосфамида используются в большинстве режимов, применяемых при лечении больных раком яичек (8) и яичников (9). Наиболее часто используемыми режимами, применяемыми при лечении больных мелкоклеточным раком легкого, являются циклофосфамид, кармустин и цисплатин (СВР) или ифосфамид, карбоплатин и этопозид (ICE) (10).
Токсичность высокодозных режимов
Гранулоцитопения наблюдается у всех больных, получивших высокодозную терапию, и увеличивает риск развития бактериальных, вирусных и грибковых инфекций. Инфекция представляет собой серьезное осложнение, увеличивающее посттрансплантационную летальность. Негематологическая токсичность включает тошноту, рвоту, стоматиты и алопецию и встречается у всех пациентов. (11). Веноокклюзионная болезнь печени и идиопатический пульмонит встречаются примерно у 10% больных, получивших ВХТ/ТКПГ, и являются наиболее частой причиной токсической смертности. Наличие в анамнезе гепатита является наиболее важным фактором риска для развития веноокклюзионной болезни печени. Несмотря на то, что большинство пневмоний имеют инфекционную этиологию, от 5% до 10% пациентов имеют интерстициальное повреждение легких или диффузное вовлечение альвеол (11).
Трансфузии тромбоцитов проводятся для поддержания уровня тромбоцитов крови не ниже 20×10 9 /л. Пациенты, серонегативные по цитомегаловирусу, должны получать компоненты крови от серонегативных доноров. Все компоненты крови должны подвергаться облучению.
В посттрансплантационный период пациенты должны быть обеспечены энтеральным/парентеральным питанием в зависимости от индивидуальных потребностей. Парентеральное питание в настоящее время не является абсолютно рекомендованным для всех пациентов, получивших высокодозную химиотерапию. Мощные анальгетики должны использоваться для обезболивания. Необходимо назначение ростовых факторов (Г-КСФ, ГМ-КСФ) с момента трансплантации до момента восстановления гемопоэза (2).
II. КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Рак молочной железы
Местно-распространенный рак молочной железы
Исследования II фазы с медианой наблюдения 3,5 года показали вероятность безрецидивной выживаемости от 48% до 72% у пациентов данной группы, получивших высокодозную химиотерапию (12-15). Однако 4 рандомизированных исследования, сравнивавших ВХТ/ТКПГ со стандартной терапией, не показали преимуществ высокодозной химиотерапии, более того токсичность высокодозного лечения (включая токсическую смертность) была выше.
Метастатический рак молочной железы
Метастатический рак молочной железы в настоящее время неизлечим. Медиана выживаемости больных колеблется между 18 и 30 мес. Лишь 30% больных переживают 2 года, 5-летняя выживаемость с момента диагноза не превышает 5%. (16). Исследования II фазы показали возможность достижения 5-летней выживаемости больных с метастатическим раком молочной железы в 15-36% (17), однако рандомизированные исследования не подтвердили улучшения выживаемости больных, получивших высокодозную химиотерапию по сравнению со стандартной (18, 19). Токсичность высокодозной химиотерапии также была выше.
В этих исследованиях пациенты получали как минимум 2 цикла терапии спасения, содержащей цисплатин и ифосфамид, с последующими 1 или 2 курсами высокодозной химиотерапии. Смертность, ассоциированная с лечением, составила 4%, длительные полные ремиссии наблюдались у 33-56% больных (8, 20).
В рандомизированном исследовании пациенты контрольной группы получали 3-4 цикла высоких доз цисплатина (200 мг/м 2 ) в комбинации со стандартными дозами этопозида и блеомицина. Пациенты экспериментальной группы получали 2 аналогичных курса с последующей высокодозной химиотерапией. Экспериментальное лечение при большей токсичности не улучшило прогноз больных. Исследование II фазы показали возможность достижения 2-х летней безрецидивной выживаемости в 74% случаев при токсической смертности у 8% больных, получивших лечение высокими дозами циклофосфамида, этопозида и цисплатина с поддержкой ростовыми факторами или стволовыми клетками крови.
Рак яичников и мелкоклеточный рак легкого
Несмотря на отсутствие рандомизированных исследований, ABMTR были проанализированы результаты высокодозного лечения 421 пациентки раком яичников и 103 больных мелкоклеточным раком легкого, получивших лечение с 1989 по 1997 гг. (9, 10). Наилучшие результаты были получены у пациентов с чувствительным к препаратам платины рецидивом рака яичников и у молодых (моложе 50 лет) больных ограниченной стадией мелкоклеточного рака легкого. Двухлетняя выживаемость больных раком яичников составила 39%, а токсическая смертность снизилась с 19% в 1989 г. до 8%. Трехлетняя выживаемость больных мелкоклеточным раком легкого составил 43% при токсической смертности в 11% (9, 10).
Селекция пациентов является ключевым моментом, необходимым для оптимизации результатов лечения. Наилучшие результаты были отмечены у больных, получивших высокодозную химиотерапию на более ранних стадиях заболевания, когда размеры опухоли и количество резистентных клонов невелики. Пользу от проведения высокодозного лечения получают пациенты, страдающие раком яичек или яичников в первом чувствительном рецидиве, и больные с ограниченной стадией мелкоклеточного рака легкого. Новые высокодозные режимы, которые могут быть использованы в первой линии лечения больных раком молочной железы, также нуждаются в изучении. Необходимы усилия для разработки новых цитопротекторов, способных снизить токсичность высокодозного лечения, и иммунотерапии, позволяющей контролировать минимальную остаточную болезнь.
Список литературы:
1. Frei III E, Antman K, Teicher B, Eder P and Schnipper L. Bone Marrow autotransplantation for solid tumors-prospects. J Clin Oncol 1989, 7: 515-526.
2. Blume KG. Thomas ED. A review of autologous hematopoeitic cell transplantation. Biol Blood Marrow Transplant 2000, 6: 1-12.
3. Bensinger W, Appelbaum F, Rowley S, et al. Factors that influence collection and engraftment of autologous peripheral-blood stem cells. J Clin Oncol 1995, 13: 2547-2555.
4. Gutierrez-Delgado F, Bensinger WI. The safety of G-CSF in normal donors. Curr Opin Hematol 2001; 8:155-160.
5. Bensinger WI. Should we purge? Bone Marrow Transplant, 1998, 21: 113-15.
6. Rowley SD, Bensinger W, Gooley T et al. The effect of cell concentration on bone marrow and peripheral blood stem cell cryopreservation. Blood, 1994, 83: 2731-2736.
7. Gutierrez-Delgado F, Holmberg LA, Hooper H, et al. High-dose busulfan, melphalan and thiotepa as consolidation for non-inflammatory high-risk breast cancer. Bone Marrow Transplant 2000; 26:51-59.
8. Nichols CR. Hematopoietic cell transplantation in germ cell tumors, in: Thomas ED, Forman SJ, Blume KG (eds). Stem Cell Transplantation. Blackwell Scientific: Boston, MA, 1999, pp 1049-1057.
9. Stiff PJ, Veum-Stone J, Lazarus HM et al. High-dose chemotherapy and autologous stem-cell transplantation for ovarian cancer: an Autologous Blood and Marrow Transplant Registry Report. Ann Intern Med 2000, 133: 504-515.
10. Rizzo, JD, Elias AD, Stiff PJ. Autologous stem cell transplantation for small cell lung cancer. Biol Blood Marrow Transplant 2002, 8: 273-280.
11. Bearman S, Appelbaum F, Buckner C et al. Regimen-related toxicity in patients undergoing bone marrow transplantation. J Clin Oncol 1988, 6: 1562-1568.
12. Rhodenhuis S, Richel D, van der Wall E, et al. Randomized trial of high-dose chemotherapy and haemopoietic progenitor-cell support in operable breast cancer with extensive axillary lymph-node involvement. Lancet 1998; 352: 515-521.
13. Hortobagyi GN, Buzdar AU, Theriault RL et al. Randomized trial of high-dose chemotherapy and blood cell autografts for high-risk primary breast carcinoma J Natl Cancer Inst 2000; 92: 225-233.
14. Bergh J, Wiklund T, Erikstein et al. Tailored fluorouracil, epirubicin and cyclophosphamide compared with marrow-supported high-dose chemotherapy as adjuvant treatment for high-risk breast cancer; a randomized trial. Lancet 2000, 356: 1384-1391.
15. Peters WP, Rosner G, Vredemburgh JJ et al. A prospective, randomized comparison of two doses of combination alkylating agents as consolidation after CAF in high-risk primary involving ten or more axillary lymph nodes: preliminary results of CALGB 9082/SWOG 9114/NCIC MA-Proc. Am Soc Clin Oncol 1999; 18: (Abstr 2).
16. Clark G, Sledge GW, Osborne CD, et al. Survival from first recurrence: relative importance of prognostic factors in 1015 breast cancer patients. J Clin Oncol. 1986, 5: 55-61.
17. Bensinger WI, Schiffman KS, Holmberg L, et al: High-dose busulfan, melphalan, thiotepa and peripheral blood stem cell infusion for the treatment of metastatic breast cancer. Bone Marrow Transplant. 1997; 19: 1183-1189.
18. Lotz-JP, Cure H, Janvier, et al. High-dose chemotherapy with hematopoeitic stem cell transplantation for metastatic breast cancer: results of the French protocol PEGASE 04. Proc. Am Soc Clin Oncol 1999; 18: (Abstr 161).
19. Stadtmauer EA, O’Neill A, Goldstein LJ, et al: Conventional-dose chemotherapy compared with high-dose chemotherapy plus autologous hematopoietic stem-cell transplantation for metastatic breast cancer. Philadephia Bone Marrow Transplant Group. N Eng J Med. 2000;342: 1069-1076.
20. Flechon A, Culine S, Droz JP. Intensive and timely chemotherapy, the key of success in testicular cancer. Critical Rev Oncol Hematol 2001, 37: 35-46.